Quest’anno celebriamo i cento anni dalla nascita della meccanica quantistica nella sua formulazione moderna, un traguardo fondamentale per la nostra comprensione del mondo fisico. La teoria quantistica rappresenta infatti una svolta radicale rispetto alla fisica che l’ha preceduta, consentendo di spiegare il comportamento della materia su scala microscopica e, di conseguenza, di sfruttarne le proprietà per realizzare nuove tecnologie. Un esempio emblematico è il transistor, componente essenziale di tutta l’elettronica moderna, dai computer ai cellulari. Oppure pensiamo ai LED, tecnologia basata su fenomeni quantistici che ha rivoluzionato l’illuminazione moderna, garantendo una significativa riduzione del consumo di energia elettrica. E più recentemente, la promettente frontiera dei computer quantistici, capaci di eseguire calcoli ben oltre le possibilità dei computer tradizionali.
La nascita della meccanica quantistica è stata preceduta da un lungo e travagliato periodo durato circa venticinque anni, durante i quali i fisici non riuscivano più a descrivere il mondo con gli strumenti della fisica classica, ma non avevano ancora a disposizione nuovi strumenti. Al centro della crisi c’era la questione di come è fatta la materia, un dilemma già discusso dagli antichi filosofi greci e risolto definitivamente con la conferma dell’esistenza degli atomi, grazie agli esperimenti sul moto browniano condotti da Jean Perrin tra il 1908 e il 1909. Questo risultato rappresenta uno dei grandi successi della scienza moderna, seppure maturato in mezzo a controversie profonde e talvolta drammatiche. Un esempio emblematico è la vicenda di Ludwig Boltzmann, che si suicidò il 5 settembre 1906 a Duino, gravemente provato da problemi di salute mentale e fisica, ulteriormente acuiti dalle polemiche scientifiche che circondavano la sua teoria atomistica.
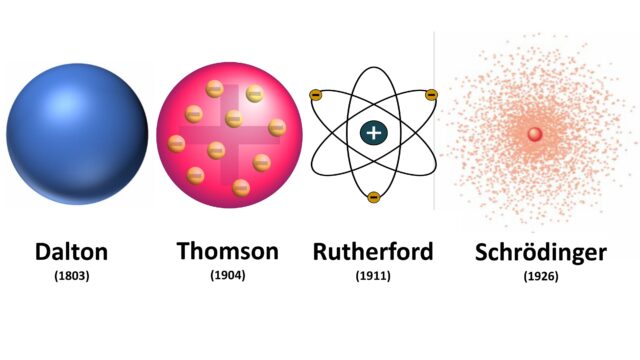
Proprio la conferma dell’esistenza degli atomi si rivelò decisiva per il crollo dell’impianto concettuale della fisica classica e la nascita della meccanica quantistica. Agli inizi dell’Ottocento, John Dalton propose il primo modello atomico moderno, immaginando gli atomi come piccole sfere di materia. Circa un secolo dopo, a valle della scoperta degli elettroni, Joseph John Thomson introdusse il cosiddetto modello “a panettone”: una massa di carica positiva in cui erano disseminati gli elettroni di carica negativa come uvette. Questo modello, tuttavia, non superò le prove sperimentali successive.
Ernest Rutherford allora propose un modello planetario, nel quale l’atomo risultava essere sostanzialmente vuoto, con un nucleo centrale compatto contenente quasi tutta la massa e gli elettroni orbitanti attorno ad esso, simili ai pianeti che ruotano attorno al sole. Questo schema, seppur conforme alle evidenze sperimentali, incontrava un problema: secondo l’elettromagnetismo classico, gli elettroni nel loro moto all’interno dell’atomo avrebbero dovuto emettere radiazione, perdendo rapidamente energia fino a precipitare sul nucleo. Per inciso, è proprio attraverso questo meccanismo di emissione di radiazione da parte degli elettroni che i moderni cellulari inviano i segnali alle antenne, che a loro volta li direzionano verso i destinatari del messaggio.
Questa incapacità di spiegare il comportamento degli elettroni nell’atomo rappresenta un fallimento spettacolare della fisica classica: dopo tre secoli di successi, la teoria non riesce più a spiegare perché la materia è stabile, e l’impianto concettuale costruito da Galileo e Newton crolla definitivamente.
La soluzione a questa crisi arrivò grazie ai contributi fondamentali dei fisici Niels Bohr, Louis de Broglie, Werner Heisenberg e Erwin Schrödinger, che cent’anni fa riformularono completamente la descrizione dell’atomo e quindi della materia. Gli elettroni, e con essi tutte le altre particelle, non sono delle vere e proprie particelle: piuttosto, si comportano diversamente se sottoposte a una misura oppure no. Quando vengono osservate, si comportano come particelle localizzate; quando invece non sono osservate, sembrano comportarsi come un’onda che si diluisce nello spazio un po’ come le onde del mare. In particolare, dentro l’atomo, gli elettroni-onda si avviluppano attorno al nucleo generando configurazioni stabili, ossia gli orbitali atomici su cui si fonda tutta la moderna chimica e la scienza dei materiali.

La rivoluzione concettuale portata dalla meccanica quantistica parte proprio da queste premesse per arrivare ad un risultato radicale: l’onda introdotta da de Broglie e poi ripresa da Schrödinger non va intesa come un’onda di materia, come l’onda del mare. È un oggetto più astratto: è un’onda di probabilità, la cui funzione è indicare la probabilità di trovare una particella in un certo punto al momento di una misura. Ma l’onda non descrive com’è la particella prima della misura.
In questo modo si rinuncia alla possibilità di costruire un’immagine del mondo, quello che da sempre era stato l’obiettivo dell’indagine fisico/filosofica. Siamo passati così da una rappresentazione classica e deterministica della natura, paragonabile a un orologio perfetto che segue regole certe e prevedibili, a una descrizione intrinsecamente indeterminata e probabilistica. Questo cambiamento radicale continua ancora oggi a generare interrogativi profondi, mantenendo aperte affascinanti questioni filosofiche e scientifiche.
Angelo Bassi
professore ordinario di Fisica Teorica al Dipartimento di Fisica
dell’Università degli Studi di Trieste
Foto in evidenza: Wikimedia By en:Paul Ehrenfest
Grazie per aver letto questo articolo. Se vuoi restare aggiornato ti invitiamo a iscriverti al nostro canale Whatsapp cliccando qui



